Čo je oxid uhoľnatý? Štruktúra molekuly
Oxid uhoľnatý, tiež známy ako oxid uhoľnatýplyn, má veľmi silné molekulové zloženie, je inertný vo svojich chemických vlastnostiach a málo rozpustný vo vode. Táto zlúčenina je tiež neuveriteľne jedovatá, keď vstúpi do dýchacieho systému, spája sa s hemoglobínom v krvi a zastavuje prenos kyslíka do tkanív a orgánov.
Chemické názvy a vzorce
Oxid uhoľnatý je tiež známy pod inýminázvov vrátane oxidu uhoľnatého II. V každodennom živote sa zvyčajne nazýva oxid uhoľnatý. Tento oxid uhoľnatý je jedovatý, bezfarebný a bez chuti, ktorý je bez zápachu. Jeho chemický vzorec je CO a hmotnosť jednej molekuly je 28,01 g / mol.

Účinky na telo
Oxid uhoľnatý sa spája s hemoglobínomtvorba karboxyhemoglobínu, ktorá nemá kapacitu kyslíka. Vdýchnutie jeho pár spôsobuje poškodenie centrálneho nervového systému (CNS) a udusenie. Výsledný nedostatok kyslíka spôsobuje bolesť hlavy, závrat, znížený pulz a rýchlosť dýchania, čo vedie k mdlobu a následnej smrti tela.

Toxický plyn
Oxid uhoľnatý sa vyrába čiastočnespaľovanie látok obsahujúcich uhlík, napríklad v spaľovacích motoroch. Zlúčenina obsahuje 1 atóm uhlíka, kovalentne viazaný k 1 atómu kyslíka. Oxid uhoľnatý je veľmi toxický a to je jedna z najčastejších príčin smrteľných otráv po celom svete. Expozícia môže viesť k poškodeniu srdca a iných orgánov.

Aké je použitie oxidu uhoľnatého?
Napriek svojej vážnej toxicite, monoxiduhlík je mimoriadne užitočný - vďaka modernej technológii je z neho vytvorených niekoľko životne dôležitých produktov. Oxid uhoľnatý, aj keď je dnes považovaná za kontaminant vždy prítomný v prírode, ale nie v takom množstve, ako je napríklad oxid uhličitý.
Tí, ktorí veria, že neexistujú, sa mýliazlúčeniny oxidu uhoľnatého v prírode. CO sa rozpúšťa v roztavenej vulkanickej hornine pri vysokých tlakoch v plášti zeme. Obsah oxidov uhlíka v sopečných plynoch sa pohybuje v rozmedzí od 0,01% do 2% v závislosti od sopky. Pretože prirodzená hodnota tejto zlúčeniny nie je konštantná hodnota, nie je možné presne merať emisie zemného plynu.

Chemické vlastnosti
Oxid uhoľnatý (CO-vzorec) sa vzťahuje na oxidy, ktoré nie sú soľou alebo indiferentné. Avšak pri teplote +200 oC reaguje s hydroxidom sodným. Počas tohto chemického procesu sa tvorí mravčan sodný:
NaOH + CO = HCOONa (soľ kyseliny mravčej).
Vlastnosti oxidu uhoľnatého sú založené na jeho redukčnej schopnosti. Oxid uhoľnatý:
- môže reagovať s kyslíkom: 2CO + O2 = 2CO2;
- je schopný reagovať s halogénmi: CO + Cl2 = COCI2 (Fosgén);
- má jedinečnú vlastnosť na regeneráciu čistých kovov z ich oxidov: Fe2O3 + 3CO = 2Fe + 3CO2;
- tvorí karbonyly kovov: Fe + 5CO = Fe (CO)5;
- dokonale rozpustné v chloroforme, kyseline octovej, etanole, hydroxide amónnom a benzéne.
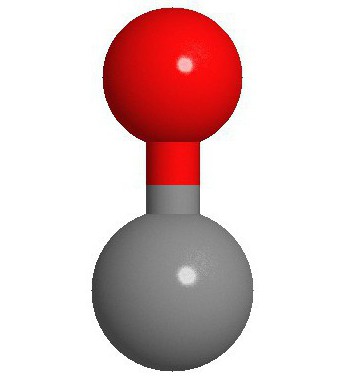
Molekulová štruktúra
Dva atómy, z ktorých v skutočnosti spočívamolekula oxidu uhoľnatého (CO) sú spojené trojitou väzbou. Dve z nich sú tvorené fúziou p-elektrónov atómov uhlíka s kyslíkom a tretia je spôsobená špeciálnym mechanizmom kvôli voľným 2p-orbitálnym atómom uhlíka a 2p-elektrónovým kyslíkovým párom. Táto štruktúra poskytuje molekulu s vysokou pevnosťou.
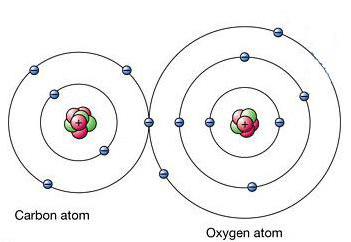
Trochu histórie
Aristoteles z dávneho Grécka opísaltoxických dymov vyprodukovaných spaľovaním uhlia. Mechanizmus samotnej smrti nebol známy. Jednou zo starodávnych metód popravy však bolo zablokovanie porušujúceho sa zákona v parnej miestnosti, kde sa nachádzali horáky. Grénský lekár naznačil, že vo vzduchu vznikajú určité zmeny, ktoré pri inhalácii spôsobujú ujmu.
Počas druhej svetovej vojny došlo k zmiešaniu zmesi plynovnečistoty oxidu uhoľnatého sa použili ako palivo pre vozidlá v tých častiach sveta, kde bolo obmedzené množstvo benzínu a motorovej nafty. Z vonkajšej strany (s niekoľkými výnimkami) boli inštalované generátory dreveného uhlia alebo dreveného plynu a do plynového mixéra bola privádzaná zmes atmosférického dusíka, oxidu uhoľnatého a malého množstva iných plynov. Bol to takzvaný drevný plyn.

Oxidácia oxidu uhoľnatého
Oxid uhoľnatý sa tvorí čiastočnou oxidáciou zlúčenín obsahujúcich uhlík. CO vzniká, keď kyslík nie je dostatočný na produkciu oxidu uhličitého (CO2), napríklad keď je pec alebo motor v prevádzkespaľovanie v uzavretom priestore. Ak je kyslík prítomný, rovnako ako niektoré iné atmosferické koncentrácie, oxid uhoľnatý spaľuje, emituje modré svetlo a vytvára oxid uhličitý, známy ako oxid uhličitý.
Uhoľný plyn, široko používaný až do šesťdesiatych rokovV minulom storočí pre vnútorné osvetlenie, varenie a vykurovanie mal CO v zložení ako výhodnú zložku paliva. Niektoré procesy v moderných technológiách, ako je tavenie železa, stále produkujú oxid uhoľnatý ako vedľajší produkt. Samotná zlúčenina CO je oxidovaná v CO2 pri teplote miestnosti.

Existuje povaha CO?
Existuje v prírode oxid uhoľnatý? Jedným z jeho prírodných zdrojov sú fotochemické reakcie vyskytujúce sa v troposfére. Tieto procesy majú generovať približne 5 × 1012 kg látky e; Ďalšie zdroje, ako už bolo spomenuté vyššie, sú sopky, lesné požiare a iné druhy popálenín.
Molekulové vlastnosti
Oxid uhoľnatý má molárnu hmotnosť 28,0, čo jerobí to o niečo menej husté ako vzduch. Dĺžka väzby medzi týmito dvoma atómami je 112,8 mikrometrov. Je dosť blízko, že poskytuje jednu z najsilnejších chemických väzieb. Oba prvky v zlúčenine CO spolu majú približne 10 elektrónov v jednej valenčnej škrupine.
Ako pravidlo, v organických karbonylzlúčenín existuje dvojitá väzba. Charakteristickým rysom molekuly CO je, že medzi atómami existuje silná trojitá väzba so šiestimi bežnými elektrónmi v troch viazaných molekulárnych orbitaloch. Keďže 4 spoločné elektróny pochádzajú z atómu kyslíka a len 2 z uhlíka, jedna viazaná orbitálna je obsadená dvoma elektrónmi z O2, pričom vzniká dative alebo dipólová väzba. To spôsobuje polarizáciu C ← O molekuly s malým nábojom "-" na uhlíku a malým nábojom "+" na kyslíku.
Zostávajúce dve pridružené orbitaly zaberajú jednunabitá častica z uhlíka a jedna z kyslíka. Molekula je asymetrická: kyslík má väčšiu elektrónovú hustotu ako uhlík a je tiež mierne pozitívne nabitý v porovnaní s negatívnym uhlíkom.

recepcia
V priemysle sa výroba oxidu uhoľnatého CO uskutočňuje zahrievaním bez prístupu vzduchu k oxidu uhličitému alebo vodnej pary s uhlím:
CO2 + C = 2CO;
H2O + C = CO + H2.
Posledná získaná zmes sa tiež nazýva vodaalebo syntetického plynu. V laboratórnych podmienkach oxid uhoľnatý II vystavením organických kyselín koncentrovanej kyseline sírovej, ktorá pôsobí ako dehydratačné činidlo:
HCOOH = CO + H2o;
H2C2ach4 = CO2 + H2O.
Hlavné príznaky a pomoc pri otravách CO
Je otravou oxidom uhoľnatým? Áno, a veľmi silné. Otrava oxidu uhoľnatým je najčastejším fenoménom na celom svete. Najčastejšími príznakmi sú:
- pocit slabosti;
- nevoľnosť;
- závraty;
- únava;
- podráždenosť;
- zlá chuť;
- bolesť hlavy;
- dezorientácia;
- zhoršené videnie;
- vracanie;
- mdloby;
- kŕče.
Expozícia tohto toxického plynu môže spôsobiťk významnému poškodeniu, ktoré môže často viesť k dlhodobým chronickým patologickým stavom. Oxid uhoľnatý môže spôsobiť vážne poškodenie plodu tehotnej ženy. Obete, napríklad po požiari, by mali mať okamžitú pomoc. naliehavo treba zavolať sanitku, dať prístup k čerstvému vzduchu, odstrániť dýchavičnosť oblečenie, pokojné, teplé. Ťažká otravou sa spravidla zaobchádza len pod dohľadom lekárov v nemocnici.
prihláška
Ako už bolo uvedené, oxid uhoľnatý je toxický anebezpečné, ale to je jedno zo základných zlúčenín, ktoré sa používajú v modernom priemysle pre organickej syntézy. CO sa používa na výrobu čistej kovy, karbonyly, fosgén, sulfid uhličitý metylalkohol, formamid, aromatické aldehydy, kyseliny mravčej. Táto látka sa používa aj ako palivo. Cez jeho toxicity a toxicity, sa často používa ako surovina na výrobu rôznych látok v chemickom priemysle.
Oxid uhoľnatý a oxid uhličitý: aký je rozdiel?
Monoxid a oxid uhličitý (CO a CO2) sa navzájom často mýlia. Obidva plyny sú bez zápachu a bezfarebné a obidva majú negatívny vplyv na kardiovaskulárny systém. Oba plyny sa môžu dostať do tela prostredníctvom inhalácie, pokožky a očí. Tieto zlúčeniny, keď sú vystavené pôsobeniu živého organizmu, majú množstvo bežných príznakov - bolesti hlavy, závraty, kŕče a halucinácie. Väčšina ľudí má ťažkosti s určením rozdielu a nerozumie tomu, že výfuky automobilov emitujú CO aj CO2 , Vo vnútri môže byť zvýšená koncentrácia týchto plynov nebezpečná pre zdravie a bezpečnosť osoby, ktorá je vystavená. Aký je rozdiel?
Pri vysokých koncentráciách môžu byť obe smrteľné. Rozdiel je v tom, že CO2 je bežným zemným plynom, ktorý je potrebnýrastlinného a živočíšneho života. CO nie je bežný výskyt. Toto je vedľajší produkt spaľovania anoxických palív. Kritický chemický rozdiel je CO2 obsahuje jeden atóm uhlíka a dva atómy kyslíka, zatiaľ čo v CO je len jeden z nich. Oxid uhličitý je nehorľavý, pričom oxid kremičitý má vysokú pravdepodobnosť vznietenia.
Oxid uhličitý, prirodzene, sa vyskytuje v roku 2003atmosféra: ľudia a zvieratá dýchajú kyslík a vydychujú oxid uhličitý, to znamená, že živé bytosti dokážu vydržať v malom množstve. Tento plyn je tiež nevyhnutný pre rastliny na fotosyntézu. Kysličník uhoľnatý však prirodzene nevzniká v atmosfére a môže spôsobiť zdravotné problémy aj pri nízkych koncentráciách. Hustota oboch plynov je tiež odlišná. Oxid uhličitý je ťažší a hustší ako vzduch, zatiaľ čo oxid uhoľnatý je mierne ľahší. Táto funkcia by sa mala brať do úvahy pri inštalácii vhodných snímačov v domácnostiach.






