Medzinárodná nomenklatúra alkánov. Alkány: štruktúra, vlastnosti
Je užitočné začať definíciou konceptualkány. Je to nasýtené alebo nasýtené uhľovodíky, parafíny. Môžeme tiež povedať, že atómy uhlíka, v ktorej atómy zlúčenina C sa vykonáva pomocou jednoduchých vzťahov. Všeobecný vzorec je v tvare: CnH₂n + 2.
Je známe, že pomer počtu atómov H a Cvo svojich molekulách čo najviac, v porovnaní s inými triedami. Vzhľadom na skutočnosť, že všetky valencie sú obsadené buď C alebo H, chemické vlastnosti alkánov nie sú dostatočne výrazné, preto druhým pojmom je termín nasýtené alebo nasýtené uhľovodíky.
Existuje aj staršie meno, ktoré najlepšie odráža ich relatívnu chémiu - parafíny, ktoré v preklade znamená "bez afinity".
Takže téma našej dnešnej rozhovory je: "Alkáni: séria homológov, nomenklatúra, štruktúra, izomerizmus". Poskytnú sa aj údaje o ich fyzikálnych vlastnostiach.
Alkány: budova, nomenklatúra
V nich sú atómy C v takom stave akosp3 hybridizácia. Preto alkán molekula môže byť preukázaná ako súbor štvorboká konštrukcia C, ktoré sú spojené nielen medzi sebou, ale aj s H.
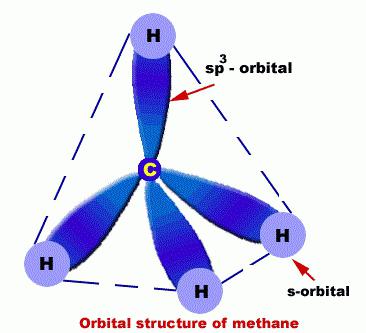
Medzi atómami C a H sú silné, veľmis-väzby s nízkou polaritou. Jednotky okolo jednoduchých väzieb sa vždy otáčajú, takže molekuly alkánov preberajú rôzne formy, pričom dĺžka väzby, pričom uhol medzi nimi je konštantný. Formy, ktoré sú premenené do seba vzhľadom na rotáciu molekuly, ktorá sa vyskytuje okolo p-väzieb, je zvykom nazývať to konformácie.
V procese oddelenia atómu H od uvažovanéhomolekuly tvoria 1-valentné častice, nazývané uhľovodíkové radikály. Vyskytujú sa v dôsledku zlúčenín nielen organických látok, ale aj anorganických zlúčenín. Ak vezmeme 2 molekuly vodíka z molekuly konečného uhľovodíka, potom získame 2-valentné radikály.
Teda nomenklatúra alkánov môže byť:
- radiálna (stará verzia);
- náhradné (medzinárodné, systematické). Navrhuje ju IUPAC.
Vlastnosti radiálnej nomenklatúry
V prvom prípade je nomenklatúra alkánov charakterizovaná nasledujúcim:
- Pozorovanie uhľovodíkov ako derivátov metánu, v ktorých jeden alebo niekoľko atómov H je substituovaných radikálmi.
- Vysoký stupeň pohodlia v prípade veľmi zložitých spojení.
Vlastnosti nomenklatúry výmeny
Alkalická nomenklatúra má nasledujúce vlastnosti:
- Základom názvu je 1 uhlíkový reťazec, zatiaľ čo zvyšné molekulové fragmenty sa považujú za substituenty.
- V prítomnosti niekoľkých rovnakých radikálov, pred ich názvom je uvedené číslo (striktne slovami) a radikálne čísla sú oddelené čiarkami.
Chémia: nomenklatúra alkánov
Pre jednoduchosť sú informácie prezentované vo forme tabuľky.
Názov látky | Základ názvu (root) | Molekulárny vzorec | Názov uhlíkového substituentu | Vzorec uhlíkového substituenta |
metán | meth | CH₄ | metyl | CH |
etán | ethno | C₂H₆ | etyl | C₂H₅ |
propán | podoprieť | C₃H₈ | Opil sa | C₃H₇ |
bután | but | C₄H₁₀O | butyl | C₄H₉ |
pentán | stiesnený | C₅H₁₂ | pentyl | C₅H₁₁ |
hexán | hex | C₆H₁₄O | hexyl | C₆H₁₃ |
heptán | hepta | C₇H₁₆ | heptyl | C₇H₁₅ |
oktán | október | C₈H₁₈ | oktyl | C₈H₁₇ |
nonan | n o | C₉H₂₀ | nonyl | C₉H₁₉ |
dekan | dextran | C₁₀H₂₂ | decyl | C₁₀H₂₁ |
Vyššie uvedená nomenklatúra alkánov zahŕňa názvy, ktoré sa historicky vyvíjali (prvých 4 členov radu koncových uhľovodíkov).
Názvy nenosených alkánov s 5 alebo viacAtómy C sú tvorené z gréckych čísel, ktoré odrážajú daný počet atómov C. Takže prípona -an hovorí, že látka je zo série nasýtených zlúčenín.

Pri zostavovaní názvov nasadených alkánov vrola hlavného reťazca je zvolená tak, aby obsahovala maximálny počet atómov C. Je číslovaný tak, že substituenty majú najnižšie číslo. V prípade dvoch alebo viacerých reťazcov rovnakej dĺžky je hlavným reťazcom ten najväčší počet substituentov.
Izomerizácia alkánov
Ako uhľovodíkový progenitor ich sériepôsobí metán CH4. Pri každom nasledujúcom zástupcov metánovej série existuje rozdiel oproti predchádzajúcemu na metylénovú skupinu - CH2. Táto pravidelnosť sa dá vysledovať v celom rozsahu alkánov.
Nemecký vedec Schiel predložil návrh nazývať túto sériu homológnou. Preložené z gréčtiny znamená "podobné, podobné."
Homológia je teda sériaktoré majú rovnakú štruktúru s podobnými chemickými vlastnosťami. Homologové sú členmi tejto série. Homologickým rozdielom je metylénová skupina, na ktorú sa líšia dva susediace homológy.
Ako už bolo spomenuté vyššie, zloženie ktoréhokoľveknasýtený uhľovodík môže byť vyjadrený všeobecným vzorcom CnH2n + 2. Ďalším členom homologickej série je teda etán-C2H následný. Na odvodenie jeho štruktúry z metánu je potrebné vymeniť 1 atóm H za CH3 (obrázok nižšie).

Štruktúra každého nasledujúceho homológu môže byť odvodená z predchádzajúceho homológu rovnakým spôsobom. Výsledkom je, že etán produkuje propán-C3H8.
Čo sú izoméry?
Ide o látky, ktoré sú identickékvalitatívne a kvantitatívne molekulárne zloženie (identický molekulový vzorec), ale majú odlišnú chemickú štruktúru, rovnako ako rôzne chemické vlastnosti.
Uvedené uhľovodíky sa líšiataký parameter ako teplota varu: -0,5 ° -bután, -10 ° -izobután. Tento druh isomerizmu sa označuje ako izomériu uhlíkatého skeletu, vzťahuje sa na štruktúrny typ.
Počet štrukturálnych izomérov rastie rýchloPri rýchlosti so zvýšením počtu atómov uhlíka. Takže C10H22 bude zodpovedať 75 izomérom (bez priestorových) a pre izoméry C17H32 sú známe 4347 izoméry, pre C20H42 je to 366 319.
Takže bolo jasné, čo alkány, homológne série, izomerizmus, nomenklatúra. Teraz musíme prejsť na pravidlá pre zostavovanie mien pre IUPAC.

Nomenklatúra IUPAC: pravidlá vytvárania mien
Po prvé, je potrebné nájsť v uhľovodíkuštruktúra uhlíkového reťazca, ktorá je najdlhšia a obsahuje maximálny počet substituentov. Potom sa vyžaduje, aby sa číslovali atómy uhlíka reťazca, počnúc koncom, na ktorý je substituent najbližší.
Po druhé, základom je názov nerozvetveného nasýteného uhľovodíka, ktorému najdôležitejší reťazec zodpovedá počtu atómov C.
Po tretie, pred základom je potrebné uviesť čísla zámkov, v blízkosti ktorých sú umiestnené substituenty. Za nimi nasleduje pomlčka s menami poslancov.
Po štvrté, v prípade identickýchsubstituenty na rôznych atómoch C lokanty spoločne, vyznačujúci sa tým, než sa objavia názov násobí prefix: di - dva zhodné substituentmi tri - na tri, tetra - štyri, penta - na päť, atď. Čísla musia byť oddelené čiarkou, .. a zo slova - s pomlčkou.
Ak rovnaký atóm C obsahuje dva substituenty naraz, lokant je tiež zaznamenaný dvakrát.
Podľa týchto pravidiel sa vytvára medzinárodná nomenklatúra alkánov.

Projekcie Newmana
Tento americký vedec navrhol špeciálne projekčné vzorce - Newmanove projekcie - pre grafické ukážky konformácií. Zodpovedajú formám A a B a sú uvedené na obrázku nižšie.

V prvom prípade ide o A-skontrolovanú konformáciu av druhej, B je retardovaný. V polohe A sú atómy H umiestnené v minimálnej vzdialenosti od seba. Tento formulár zodpovedá najväčšej hodnote energie, pretože odpudzovanie medzi nimi je najväčšie. Je to energeticky nepriaznivý stav, v dôsledku ktorého má molekula tendenciu ju opustiť a pokračovať do stabilnejšej polohy B. Tu sú atómy H v maximálnej vzdialenosti od seba. Energetický rozdiel týchto polôh je teda 12 kJ / mol, čím sa nerovnomerne dosiahne voľná rotácia okolo osi v molekule etánu, ktorá spája metylové skupiny. Po dosiahnutí energeticky výhodnej polohy sa molekula oneskorí, inými slovami, "spomalí". To je dôvod, prečo sa to nazýva zablokované. Výsledok - 10 tisíc etánových molekúl je v prekážkovej forme konformácie za podmienok izbovej teploty. Iba jedna má inú podobu - tienenú.
Získanie limitných uhľovodíkov
Z článku je už známe, že ide o alkány(štruktúra, ich názvoslovia je podrobne opísaná skôr). Nebude to zbytočné zvažovať spôsoby ich získania. Sú pridelené z takých prírodných zdrojov ako ropa, zemný plyn, súvisiaci plyn, uhlie. Používajú sa tiež syntetické metódy. Napríklad H2H2:
- Proces hydrogenácie nenasýtených uhľovodíkov: CnH2n (alkény) → CnH2n + 2 (alkány) ← CnH2n-2 (alkény).
- Zo zmesi monoxidu C a H - syntézneho plynu: nCO + (2n + 1) H2 → CnH2n + 2 + nH2O.
- Z karboxylových kyselín (ich soli): elektrolýza na anóde, na katóde:
- Kolbe elektrolýza: 2RCOONa + 2H20 -> R-R + 2CO2 + H2 + 2NaOH;
- Dumasova reakcia (zliatina s alkáliou): CH3COONa + NaOH (t) → CH4 + Na2C03.
- Krakovanie oleja: CnH2n + 2 (450-700 °) → CmH2m + 2 + Cn-mH2 (n-m).
- Splyňovanie paliva (tuhá látka): C + 2H2 → CH4.
- Syntéza komplexných alkánov (halogénovaných derivátov), ktoré majú menej atómov C: 2CH3Cl (chlórmetán) + 2Na → CH3-CH3 (etán) + 2NaCl.
- Rozklad metanidov (karbidy kovov) s vodou: Al4C3 + 12H2O → 4Al (OH3) ↓ + 3CH4 ↑.
Fyzikálne vlastnosti konečných uhľovodíkov
Pre jednoduchosť sú údaje zoskupené do tabuľky.
vzorec | alkán | Bod topenia v ° C | Bod varu v ° C | Hustota, g / ml |
CH₄ | metán | -183 | -162 | 0,415 pri t = -165 ° C |
C₂H₆ | etán | -183 | -88 | 0,561 pri t = -100 ° C |
C₃H₈ | propán | -188 | -42 | 0,583 pri t = -45 ° C |
n-C₄H₁₀O | n-bután | -139 | -0,5 | 0,579 pri t = 0 ° C |
2-metylpropán | - 160 | - 12 | 0,557 pri t = -25 ° C | |
2,2-dimetyl-propán | - 16 | 9,5 | 0,613 | |
n-C₅H₁₂ | pentán | -130 | 36 | 0,626 |
2-metylbután | - 160 | 28 | 0,620 | |
n-C₆H₁₄O | n-hexán | - 95 | 69 | 0,660 |
2-metylpentán | - 153 | 62 | 0,683 | |
n-C₇H₁₆ | n-Heptán | - 91 | 98 | 0,683 |
n-C₈H₁₈ | n-oktán | - 57 | 126 | 0,702 |
2,2,3,3-tetra-metylbután | - 100 | 106 | 0,656 | |
2,2,4-trimetylchlórsilán-pentán | - 107 | 99 | 0,692 | |
n-C₉H₂₀ | n-nonanu | - 53 | 151 | 0,718 |
n-C₁₀H₂₂ | n-dekan | - 30 | 174 | 0,730 |
n-C₁₁H₂₄ | n-undekan | - 26 | 196 | 0,740 |
n-C₁₂H₂₆ | n-dodekán | - 10 | 216 | 0,748 |
n-C₁₃H₂₈ | n-tridekan | - 5 | 235 | 0,756 |
n-C₁₄H₃₀ | n-tetradekan | 6 | 254 | 0,762 |
n-C₁₅H₃₂ | n-pentadekan | 10 | 271 | 0,768 |
n-C₁₆H₃₄ | n-hexadekánu | 18 | 287 | 0,776 |
n-C₂₀H₄₂ | n-eikosan | 37 | 343 | 0,788 |
n-C₃₀H₆₂ | n-Triakontan | 66 | 235 s 1 mm Hg. článok | 0,779 |
n-C₄₀H₈₂ | n-Tetrakontan | 81 | 260 na 3 mm ortuť. Art. | |
n-C₅₀H₁₀₂ | n-Pentakontan | 92 | 420 na 15 mm ortuť. Art. | |
n-C₆₀H₁₂₂ | n-Geksakontan | 99 | ||
n-C₇₀H₁₄₂ | n-Geptakontan | 105 | ||
n-C₁₀₀H₂₀₂ | n-Gektan | 115 |
záver
Článok považoval taký koncept akoalkány (štruktúra, nomenklatúra, izoméria, homológia, atď.). Trochu sa hovorí o vlastnostiach radiálnych a náhradných nomenklatúr. Sú opísané spôsoby prípravy alkánov.
Okrem toho článok podrobne uvádza zoznam nomenklatúry alkánov (test môže pomôcť asimilovať získané informácie).